检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
三阴性乳腺癌(triple-negative breast cancer, TNBC)长期缺乏有效治疗手段,具有侵袭性强、预后差、易复发转移的特点。近年来,虽然免疫检查点抑制剂(如PD-1/PD-L1抑制剂)在临床上取得了巨大进展,但TNBC患者的肿瘤内部缺乏免疫细胞,呈现出“冷”肿瘤的特征,导致免疫治疗对其效果有限。这主要是由于大多数TNBC患者的肿瘤内部被致密的细胞外基质(Extracellular matrix, ECM)包裹,形成一道物理屏障,将免疫细胞“拒之门外”。因此,如何将“冷”肿瘤变“热”是提高TNBC免疫治疗效果的热点和难点。
近日,我院邓贤明教授/李莉副教授团队在Cell Reports Medicine杂志上发表题为“Inhibiting NEDD4 in Triple-Negative Breast Cancer Cells Reprograms Tumor Immune Microenvironment via the β-TrCP/YAP/ECM Axis”的研究论文。该研究揭示了E3泛素连接酶NEDD4是操控TNBC肿瘤免疫微环境的关键“开关”,靶向抑制NEDD4可实现将TNBC从“冷”→“热”肿瘤的转变,为TNBC的免疫治疗提供新策略。

研究团队通过临床数据研究发现,NEDD4在TNBC患者中高表达,且其表达量与患者的不良预后显著负相关。为了探究NEDD4在TNBC肿瘤生长中的作用,研究团队在肿瘤细胞内敲除NEDD4基因进行皮下移植瘤造模。在免疫系统健全的小鼠体内,NEDD4缺失可以显著抑制肿瘤的生长;而在免疫缺陷的小鼠体内,肿瘤生长则不受影响。这一关键实验表明,NEDD4缺失带来的抗癌效果依赖于宿主自身的免疫系统。进一步,研究人员利用肿瘤组织流式、免疫荧光、免疫组化等证实CD8+ T细胞是该抗癌效果的核心执行者。通过对129例患者的TNBC样本分析发现,NEDD4高表达与患者肿瘤内部CD8+ T细胞的减少显著相关,进一步证实了NEDD4是TNBC肿瘤免疫应答的负调节因子。
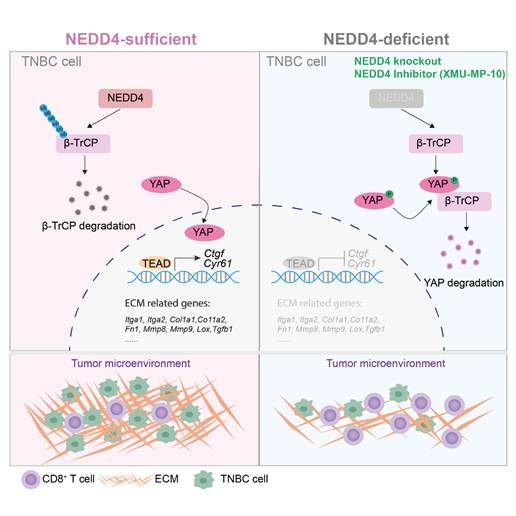
那么,癌细胞中的NEDD4是如何调控肿瘤免疫微环境的呢? NEDD4是一个重要的E3泛素连接酶。研究发现,NEDD4缺失后,能够稳定其下游E3泛素连接酶β-TrCP的蛋白水平,促进转录因子YAP蛋白降解;YAP的降解进一步抑制其下游基因转录,导致胶原蛋白等ECM成分减少,原本致密的肿瘤间质变得“疏松”,从而打通了CD8+ T细胞进入肿瘤组织的通道,使其能够顺利浸润并杀伤肿瘤细胞。
以上功能和机制研究为增强TNBC的抗肿瘤免疫提供了NEDD4这一潜在靶标。通过计算机虚拟筛选和体外结合实验验证,研究团队从实验室自主构建的6642个新型化合物中,成功发现并优化出一种高效、特异性的NEDD4小分子抑制剂—XMU-MP-10。在免疫系统健全的小鼠模型中,XMU-MP-10通过激活β-TrCP/YAP/ECM轴,降低了肿瘤胶原密度,促进了CD8+ T细胞的浸润,进而显著抑制TNBC肿瘤的生长。在更接近临床的“免疫人源化”小鼠模型huPBMC-NCG中,XMU-MP-10再次证实了其抑制TNBC肿瘤生长和重塑免疫微环境的能力,显示出其潜在的临床转化价值。
综上,该研究不仅明确了三阴性乳腺癌中NEDD4可作为增强抗肿瘤免疫的有效靶点,揭示了靶向抑制NEDD4通过调节β-TrCP-YAP-ECM信号轴实现TNBC从“冷”肿瘤转化为“热”肿瘤的关键作用,还成功开发了具有显著体内抗肿瘤活性的新型NEDD4抑制剂XMU-MP-10,为NEDD4的靶向药物开发奠定了坚实基础。
厦门大学生命科学学院博士后苏楠、博士连文华为该论文共同第一作者,李莉副教授和邓贤明教授为共同通讯作者。该研究得到我院郑世进教授、王洪睿教授、周大旺教授、陈兰芬教授、吴乔教授、曾涛玲副教授以及厦门大学生物医学仪器共享平台的大力支持,获得了国家重点研发计划、国家自然科学基金委、中央高校基本科研业务费专项资金、厦门南方海洋中心、教育部“111计划”和新基石基金会科学探索奖等项目的资助。
原文链接:https://doi.org/10.1016/j.xcrm.2025.102420
(图/文 邓贤明团队)