检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2025年9月10日,我院邓贤明团队与中国科学院分子细胞科学卓越创新中心姜海团队合作,在《Nature Biotechnology》在线发表题为 A rapid imaging-based screen for induced-proximity degraders identifies a potent degrader of oncoprotein SKP2 的研究论文。该研究突破性地构建了一种基于“死亡-存活”表型转换的高通量蛋白降解剂筛选体系(DEFUSE),并利用该平台成功发现了一个新型分子胶降解剂SKPer1,其可通过泛素连接酶STUB1高效降解肿瘤驱动蛋白SKP2,为攻克“不可成药”靶点提供了全新的技术路径与候选分子。

超过80%的人类蛋白质缺乏传统意义上的酶活性中心或明确的小分子结合口袋,被归类为“难以成药”(undruggable)靶点。其中包括MYC、KRAS、SKP2等在癌症中发挥关键驱动作用的蛋白,长期以来缺乏有效的靶向治疗手段。分子胶降解剂(molecular glue degraders)作为一种新兴的治疗策略,通过诱导靶蛋白与E3泛素连接酶之间的异源蛋白-蛋白相互作用,促使靶蛋白被泛素化并经由蛋白酶体降解。该过程不依赖于靶蛋白的催化活性或深口袋结构,仅需形成稳定的三元复合物界面,因而被认为是攻克“不可成药”靶点最具前景的技术之一。然而,分子胶的发现长期依赖于偶然观察和经验筛选,缺乏系统性、可扩展的高通量筛选方法,严重制约了该领域的发展。现有技术难以在细胞水平实时、灵敏地捕捉化合物诱导的蛋白降解事件,导致筛选效率低下、成本高昂。
针对这一瓶颈,姜海团队创新性地开发了名为DEFUSE(Degron-based Functional Ubiquitin-mediated Screening Engine)的高通量筛选平台。该系统巧妙地将目标蛋白与一个可诱导的“自杀模块”——FKBP12-F36V–ΔCaspase9(F-C)融合表达于稳定细胞系中。在无外源化合物干预时,加入二聚化剂AP1903即可激活F-C蛋白,触发细胞内caspase级联反应,导致细胞在数小时内完全死亡。当文库中的化合物能够诱导目标蛋白降解时,与其融合的F-C蛋白亦被共降解。此时再加入AP1903,因细胞中已无功能性F-C蛋白,细胞得以存活。因此,目标蛋白是否被降解,被直接转化为“细胞死亡”或“细胞存活”的清晰表型,实现了从微观分子事件到宏观可视化读出的精准转换。研究团队证实,利用DEFUSE系统,可在一周内完成上万种化合物对多个靶点的系统性筛选,极大提升了蛋白降解剂发现的效率与可及性。
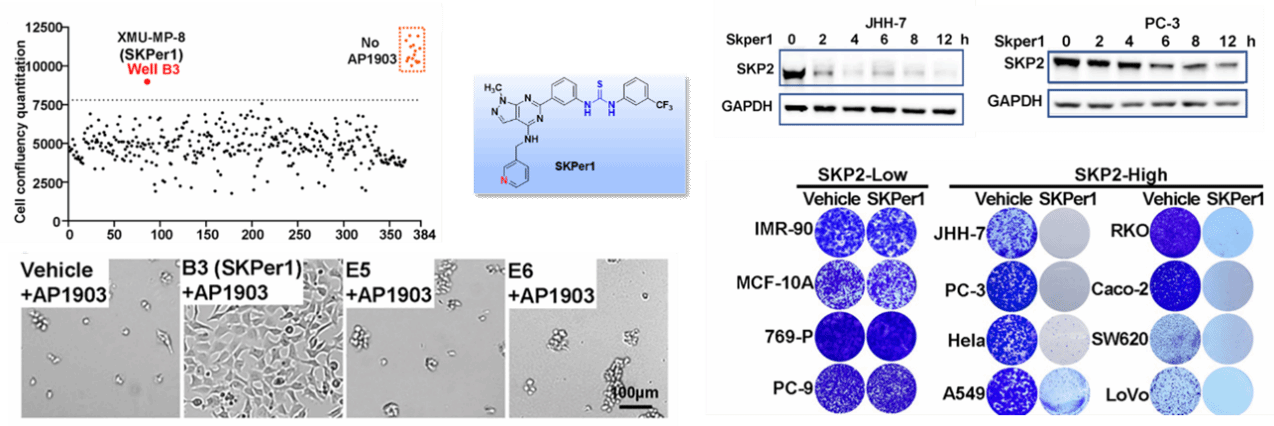
图1.难靶蛋白SKP2的小分子降解剂SKPer1的发现
基于DEFUSE平台,邓贤明团队与姜海团队联合进行了肿瘤驱动因子SKP2(S-phase kinase-associated protein 2)的降解剂发现研究。SKP2是SCF(SKP1-CUL1-F-box)E3泛素连接酶复合物的关键底物识别亚基,在多种癌症中高表达,促进细胞周期蛋白p27等抑癌因子的降解,是公认的“不可成药”靶点。研究团队从上万个自主设计、合成的小分子中筛选获得小分子化合物SKPer1是一种高效的SKP2降解剂。机制研究表明,SKPer1并非直接抑制SKP2功能,而是促进SKP2与另一种E3泛素连接酶STUB1之间的物理相互作用,从而诱导SKP2的泛素化与蛋白酶体依赖性降解。微量热泳动(MST)和生物层干涉(BLI)实验显示,SKPer1显著增强SKP2与STUB1的结合亲和力,符合分子胶的典型特征;泛素化实验显示,SKPer1处理后,SKP2的多聚泛素化水平显著升高,且该过程依赖于STUB1的表达。更重要的是,SKPer1表现出显著的抗肿瘤活性:其选择性杀伤SKP2高表达的癌细胞系,并在小鼠异种移植模型中展现出良好的药代动力学特性、安全性及体内抑瘤效果。
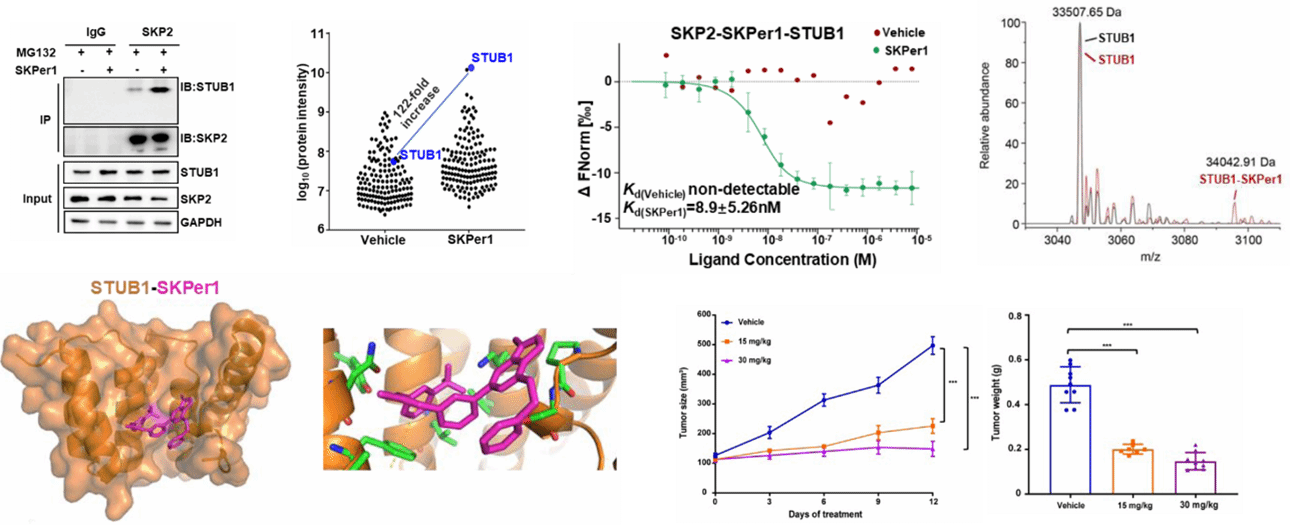
图2. SKPer1以分子胶形式介导SKP2与E3泛素连接酶STUB1的邻近效应
本研究不仅成功开发了首个基于“死亡-存活”逻辑的高通量分子胶筛选平台DEFUSE,还发现了首个SKP2的分子胶降解剂SKPer1,同时也将STUB1这一广泛表达的E3连接酶正式引入分子胶技术体系,极大拓展了可利用的工具箱。
该研究由中科院分子细胞科学卓越创新中心褚衍凯、陈奭爽、陈寅、方慧玲与厦门大学阳明洋作为共同第一作者完成,我院邓贤明教授与中科院分子细胞科学卓越创新中心姜海研究员作为共同通讯作者。该工作是邓贤明教授团队在分子胶发现领域的又一重要进展,有望推动更多“不可成药”靶点的药物发现。该项目得到了国家重点研发计划、国家自然科学基金委杰出青年基金和重大项目、新基石基金会科学探索奖的经费支持。
论文链接:https://www.nature.com/articles/s41587-025-02793-8
(图/文 邓贤明团队)