检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
核因子 κB(NF-κB)家族转录因子在多种生物的固有免疫应答中发挥关键作用,并且在多种疾病中常常发生异常激活。因此,深入理解其稳态调控机制对于开发潜在治疗策略具有重要意义。果蝇 NF-κB 前体蛋白 Relish 是哺乳动物 NF-κB 前体蛋白p100/p105的同源物,是研究NF-κB信号通路调控机制的优秀模型。尽管人们对于Relish 在免疫刺激下的激活机制已研究的较为透彻,但对于其在静息条件下的失活状态如何维持以及其激活后如何回归活性稳态的机制仍不清楚。

近日,我院刘波课题组在Cell Reports发表题为“Mask protein keeps NF-κB precursor inactive by inducing a closed conformation and isolating it in biomolecular condensates”的研究论文。该研究发现并鉴定了全新的Relish抑制因子——多重 ankyrin repeats 和单 KH 结构域蛋白 Mask。Mask蛋白能够防止Relish蛋白的异常激活,维持果蝇免疫反应的稳态。
为了揭示NF-κB 前体蛋白稳态维持的机制,研究人员首先通过免疫共沉淀结合质谱分析找到与静息的Relish蛋白存在相互作用的蛋白。随后利用细胞模型从中筛选出对Relish的活性存在显著的负调节作用的蛋白Mask,并通过果蝇在体实验发现,Mask 蛋白的缺失会显著增强固有免疫反应及抗菌肽的表达,增强果蝇对于革兰氏阴性菌的抵抗能力,从而确认了Mask是具有生理功能的NF-κB通路负调节因子。
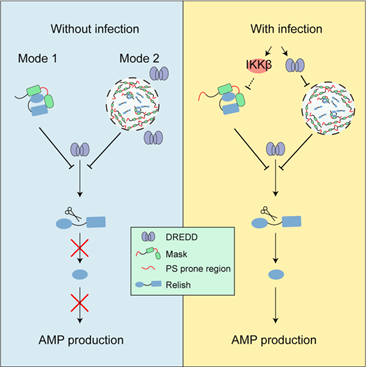
通过进一步的机制研究,团队发现Mask能够通过两套相对独立的机制来抑制Relish的活化。一方面,Mask 可以直接与 Relish 相互作用,促进其头尾区段之间的折叠,使其维持一种“闭合”的分子构象,从而阻止 Relish 被半胱天冬酶 DREDD(caspase-8的同源物,也是Relish 激活所必需的蛋白酶)切割激活。另一方面,Mask 还能通过液-液相分离(LLPS)形成生物大分子凝聚体,将 Relish 与 DREDD 在空间上隔离。进一步的实验表明,在受到细菌感染后,Mask 会以 IKKβ 依赖的方式从 Relish 上解离,同时 DREDD 能够剪切Mask并降低其凝聚体的水平,从而解除Mask对Relish的抑制。这也表明了这两种抑制策略在生理状态下的意义。
有趣的是,该研究还发现 Mask 在哺乳动物中的同源蛋白 ANKHD1 和 ANKRD17 也能够通过部分保守的机制调控 NF-κB 前体蛋白 p100/p105。总而言之,该研究揭示了 NF-κB 前体蛋白在静息条件下维持失活状态的新分子及机制,并再次体现了生物大分子凝聚体在固有免疫应答调控中的重要作用。
厦门大学生命科学学院博士生郑克伟、助理教授黄夏威为论文共同第一作者,刘波教授为通讯作者。该研究得到国家高层次青年人才计划、国家自然科学基金、福建省及厦门市自然科学基金和厦门大学校长基金资助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00996-9
(图/文 刘波团队)