检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近日,刘波课题组在Cell Reports发表题为The Hippo pathway kinase MST1 mediates a feedback loop to maintain NLRP3 inflammasome homeostasis的研究论文。该研究揭示Hippo信号通路核心激酶MST1介导了一条负反馈环路,从而调节NLRP3炎性小体以及机体炎性反应稳态。

多蛋白复合体炎性小体是介导机体炎症反应的重要因素,在机体抗感染及组织损伤修复中发挥关键作用。然而,炎性小体的过度激活会导致组织损伤以及自身免疫病、代谢疾病、神经退行性疾病及肿瘤等多种疾病。因此,炎性小体的活性受到机体严格调控,以既保证其抗感染活性又避免其过度活化造成组织损伤。 负反馈环路是细胞中介导信号通路活性稳态的重要机制,然而炎性小体活性是否受到该机制的调节仍然了解有限。
高度保守的Hippo信号通路是从果蝇中发现的一个调节器官大小的核心机制。此外,该通路也参与机体先天免疫调节。有研究表明,Hippo通路的核心成员MST1突变的人类家族呈现炎症反应异常,表现为湿疹、肺炎及鼻窦炎等症状及病原体的反复感染,提示MST激酶在炎症反应中发挥重要作用,但它在该过程中的具体作用仍然存在争议。
研究人员首先发现Mst1功能缺失的免疫细胞或小鼠中均具有更高的NLRP3炎性小体活性及炎症反应水平,表明该激酶是炎性小体的负调节因子。随后利用免疫细胞系及原代巨噬细胞作为主要模型,研究人员对该现象背后的分子机制进行了深入研究。结果显示,MST1能够直接诱导NLRP3炎性小体的关键衔接蛋白ASC的58位点丝氨酸发生磷酸化,破坏ASC寡聚位面上的电荷平衡,从而干扰ASC的寡聚化及炎性小体组装。有趣的是,研究人员进一步发现,活化的炎性小体能够通过其下游成员caspase-1,诱导MST1蛋白发生分子内剪切,解除STRIPAK磷酸酶复合体对于MST1激酶活性的抑制,从而提高MST1激酶的活性。重要的是,研究人员发现利用细菌天然产物诱导MST1剪切能够有效缓解脓毒症小鼠模型中的炎症水平,提示本研究的潜在临床意义。
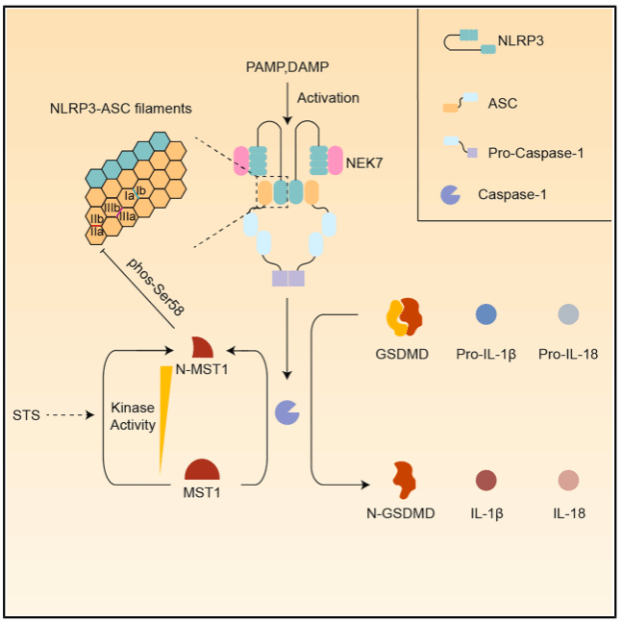
总之,这项研究发现了一个由Hippo信号通路激酶MST1介导的负反馈环路,维持ASC依赖型炎性小体以及机体炎症反应稳态,对于筛选开发靶向诱导MST1分子内剪切的抗炎药物具有重要的指导意义。
刘波课题组助理教授黄夏威、博士生王家辉为本文共同第一作者。黄夏威助理教授及刘波教授为本文的共同通讯作者。该研究得到国家高层次青年人才计划、国家自然科学基金、福建省及厦门市自然科学基金和厦门大学校长基金资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S2211124725008472
(文/图 刘波团队)