检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
细胞焦亡(Pyroptosis)是一种程序性细胞死亡形式,其由Gasdermin蛋白家族的成员介导,这些成员会发生剪切从而产生负责细胞膜穿孔的N端结构域,导致细胞内容物的释放进而激活强烈的炎症反应。cGAS-STING信号通路是先天免疫的关键调控因子,并与抗肿瘤免疫应答密切相关。目前,STING激动剂单独或与免疫检查点阻断疗法联用正作为新型抗癌疗法接受临床评估。然而,通过调控该通路直接诱导肿瘤细胞死亡的机制仍不清楚。
近日,厦门大学生命科学学院陈航姿、吴乔、邓贤明以及厦门大学药学院李福男课题组合作在The Journal of Clinical Investigation杂志发表题为《cGAS activation converges with intracellular acidification to promote STING aggregation and pyroptosis in tumor models》的研究论文。该研究发现当cGAS被激活且胞内pH降低时,细胞将发生非经典cGAS-STING通路依赖性细胞焦亡。

研究团队通过筛选发现能快速诱导肿瘤细胞焦亡的小分子化合物十二烷基6-羟基-2-萘酸酯(DHN)。机制研究表明,DHN通过促进Caspase-8介导的GSDME剪切触发细胞焦亡。随后,团队合成光敏探针DHN-P,结合点击化学技术证实DHN直接靶向线粒体蛋白CypD。进一步研究发现,DHN可诱导线粒体通透性转换孔(mPTP)持续开放,促使线粒体DNA(mtDNA)释放至胞质并与cGAS结合,引发其相分离,进而生成cGAMP激活STING。出乎意料的是,被激活的STING并未遵循经典通路从内质网转运至高尔基体,而是在内质网上形成点状聚集体。通过内质网分离纯化实验发现,DHN处理后的内质网显著富集Caspase-8和GSDME。电镜、免疫荧光、邻近标记及Triton X-100不溶组分分离等实验进一步证实,STING在内质网上聚集,从而为Caspase-8剪切GSDME提供了平台。
那么DHN处理下,STING为何无法转运至高尔基体?深入机制研究表明,DHN可诱导胞内酸化,激活PERK激酶,进而磷酸化STING的Ser345和Ser358位点。该修饰促进与cGAMP结合的STING发生多聚,导致其滞留在内质网并形成内质网-STING聚集体,最终诱导非经典cGAS-STING通路依赖性细胞焦亡。值得注意的是,在降低胞内pH的同时激活cGAS,同样可诱导细胞焦亡,证实了该机制的普适性。
在动物模型中,DHN展现出显著的抗肿瘤效果:不仅能抑制裸鼠移植瘤生长,对黑色素瘤皮下移植瘤和肝原位移植瘤也具有显著治疗效果,同时伴随抗肿瘤免疫增强且无明显毒副作用。
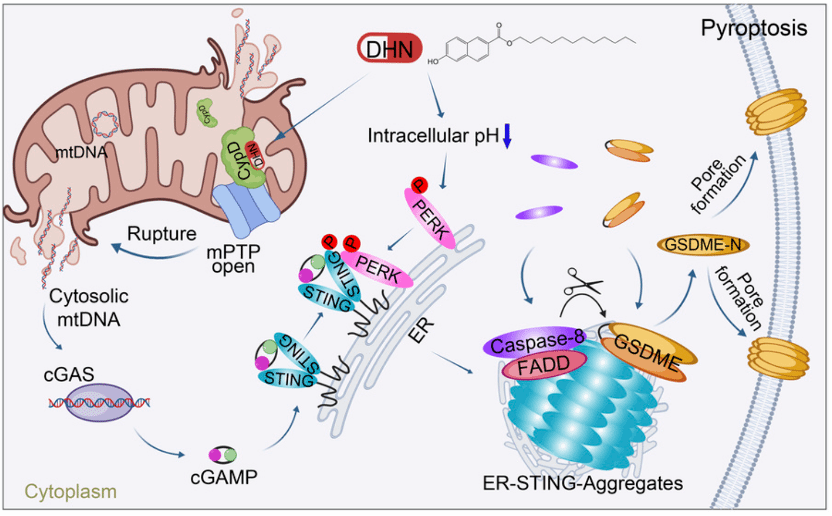
非经典cGAS-STING通路调控细胞焦亡机制模式图
本研究首次阐明:1)DHN通过靶向CypD诱导mPTP持续开放,促使mtDNA释放并激活cGAS;2)DHN引发的胞内酸化激活PERK介导的STING磷酸化,促进STING形成聚集体,为Caspase-8/GSDME提供作用平台。更重要的是,该研究揭示了cGAS-STING通路的非经典功能——当cGAS被激活且胞内pH降低时,可诱导GSDME依赖性细胞焦亡。该研究不仅拓展了我们对细胞焦亡调控网络的认识,更为肿瘤治疗提供了新靶点和先导化合物。
厦门大学陈航姿教授、吴乔教授、李福男教授和邓贤明教授为本文的共同通讯作者。厦门大学博士生肖力、博士后艾元立、博士生米香宇、硕士生梁涵和博士生支祥为本文的共同第一作者。该研究得到国家自然科学基金项目和福建省自然科学基金项目的资助。
原文链接:https://www.jci.org/articles/view/188872
(文/图 陈航姿、吴乔团队)