检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2025年11月25日,厦门大学林圣彩院士团队与福建省肿瘤医院刘景丰教授团队在Cell Research发表题为Glucose starvation mimetic aldometanib removes immune barriers permitting mice with hepatocellular carcinoma to live to normal ages的文章,揭示了“辟谷精”(aldometanib)通过激活癌旁的正常肝细胞中的AMPK,改变其代谢过程,进而逆转免疫抑制,促进CD8+ T细胞浸润肿瘤组织并清除肿瘤细胞,从而有效抑制肝癌进展并延长肝癌小鼠存活至正常寿命的现象。为肝癌治疗提供了“免疫代谢(immunotherapy)”的治疗思路,有望实现肝癌患者的荷瘤生存愿景。

肝癌病因复杂,AMPK激活剂“辟谷精”针对代谢紊乱共性抑癌
肝癌每年新发病例87万,死亡病例76万,高居所有癌症的第三位。而我国则是肝癌负担最严重的国家,每年近半数病例发生在我国。肝癌同时也是难治肿瘤之一,由于其病因复杂,导致肝癌的有效靶点少,靶向治疗疗效有限。针对多个激酶的抑制剂索拉非尼和仑伐替尼易产生耐药性,而其高度的免疫抑制的微环境,又使得免疫疗法效果不佳。特别地,在非酒精性脂肪性肝炎(NASH)引发的肝癌中,由于存在免疫抑制微环境(如调节性T细胞的聚集),抗PD-1 抗体等疗法甚至促进肝癌进展。而传统治疗手段,包括经动脉化疗栓塞(TACE)、选择性内放射治疗(SIRT)和全身化疗(Chemotherapy),虽能带来一定获益,但也因对正常肝细胞造成损害,并进一步削弱病人的免疫细胞功能而影响疗效。因此,实现肝癌的有效治疗和长期控制仍是难以企及的目标。当前的免疫疗法或许能改善部分免疫细胞功能,但却无法解决抑制性的微环境使得免疫细胞难以进入肿瘤组织行使杀伤作用这一根本问题。而相比之下,代谢紊乱是多种肝癌类型发生发展的重要共同特征,因此,代谢干预很可能成为治疗肝癌的新兴策略。
AMPK是细胞代谢调控的核心分子,负责维持机体代谢稳态,被视为治疗包括肝癌在内的多种代谢紊乱相关疾病的重要靶点。然而,先前的研究表明非生理性地、无差别地激活细胞内所有“池(pools)”的AMPK,易引发心肌肥大等毒副作用,限制了其临床应用。林圣彩院士团队针对其发现的“溶酶体AMPK通路”——一条感知生理性低糖信号并激活AMPK的途径,设计出了模拟低糖的小分子激活剂“辟谷精”。相应地,辟谷精只激活生理性低糖条件下,溶酶体pool的AMPK13。他们也的确发现了该化合物不仅能有效改善机体代谢缓解代谢性疾病,更展现出卓越的安全性。例如,辟谷精可以在短期内显著缓解高脂饮食小鼠肥胖及脂肪肝。另一方面,小鼠给药一年以上,在延长寿命的同时,不会引起心肌肥大等副作用。
于是在本研究中,作者们尝试通过“辟谷精”激活AMPK进行代谢干预治疗肝癌。结果令人惊喜,在他们测试的多种病因的肝癌,包括DEN联合高脂饮食诱导(DEN-HFD)自发肝癌(代表NASH引起的肝癌)、MYC;Trp53−/−自发肝癌(MYC和Trp53为肝癌患者最常见突变基因)、Hepa1-6原位移植瘤、人源化肝癌小鼠(肝癌细胞来自肝癌病人组织且小鼠免疫系统经过人源化处理,更贴近肝癌病人病理)等多种肝癌模型中,“辟谷精”治疗均表现出出色疗效。同时,在DEN-HFD肝癌模型的晚期(已形成明显肿瘤)进行治疗,“辟谷精”仍然可以显著抑制肝癌(图1,左)。更值得注意的是,作者们在长达约4年的生存分析实验中发现,“辟谷精”可以延长DEN-HFD肝癌小鼠寿命达到与健康小鼠相近的程度,实现了荷瘤生存的期望(图1,右)。
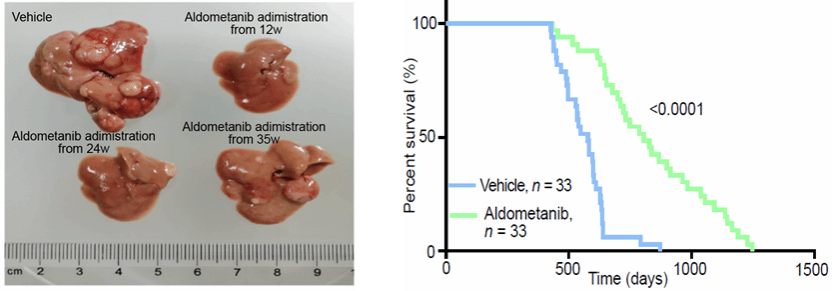
图1:“辟谷精”抑制不同时期肝癌,并延长DEN-HFD肝癌小鼠寿命,实现小鼠荷瘤生存。
机制深入解析:“辟谷精”通过“代谢免疫”新路径抑制肝癌
作者们进一步发现,与传统的化疗药不同,“辟谷精”在体外对肝癌细胞和正常肝细胞均无细胞毒性。相比较之下,在免疫缺陷小鼠中,“辟谷精”的抑癌效果消失了,这进一步提示,“辟谷精”发挥抑癌效果并不直接作用于肿瘤细胞,而是通过小鼠的免疫系统。
于是,作者们对肿瘤中28种免疫细胞类型进行了深入分析,发现“辟谷精”虽不影响CD8+ T细胞的分化成熟,却显著增强CD8+ T细胞浸润肿瘤组织及其杀伤肿瘤细胞的能力(图2,上、左下)。而当使用中和抗体清除小鼠体内CD8+ T细胞后,即阻断了“辟谷精”的抗癌效果(图2,右下)。这说明“辟谷精”是通过CD8+ T细胞行使抑制肿瘤的效果。
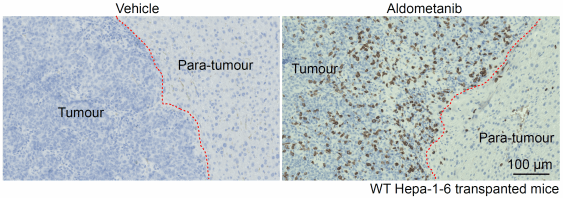
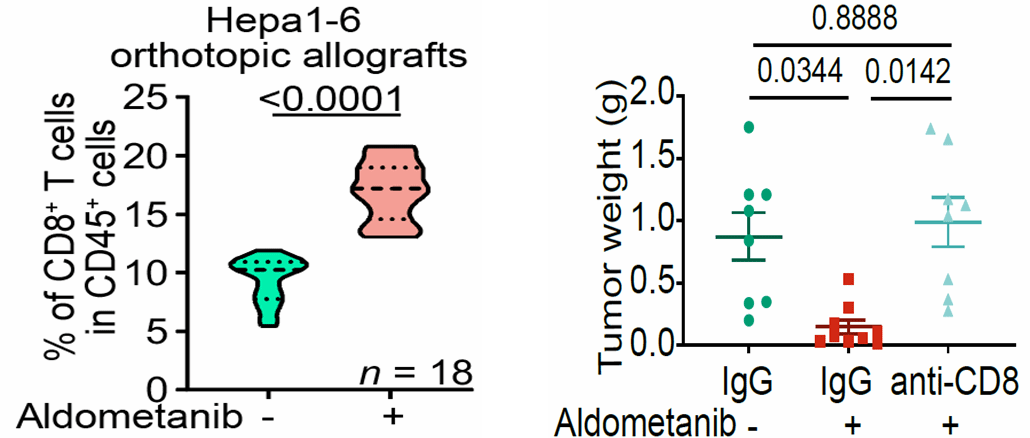
图2:“辟谷精”抑制肝癌依赖于CD8+ T细胞。
作者们也发现“辟谷精”治疗显著改善了肿瘤微环境:包括树突状细胞、B细胞、γδT在内的细胞的增加,而中性粒细胞、肿瘤相关巨噬细胞(TAMs)等免疫抑制细胞的减少。基于此,作者们检测了“辟谷精”联合PD-1抗体治疗肝癌的效果,发现辟谷精显著增强了PD-1抗体的效应,这为未来可能的联合治疗方案打下了基础。
而当作者们进一步探究“辟谷精”通过激活AMPK如何抑制肝癌时发现,肿瘤中AMPK的缺失不会影响“辟谷精”对肝癌的抑制效果,而癌旁肝细胞内的AMPK缺失却严重阻碍了“辟谷精”的抑癌效果,这说明,“辟谷精”是通过激活肝癌组织周围“土壤”中的AMPK发挥抑癌功效(图3)。也就是说,与单纯通过直接激活免疫细胞进而抗癌的思路不同,“辟谷精”通过癌旁正常肝细胞的代谢,改善肿瘤微环境,解除了免疫抑制,进而调动了机体固有的免疫系统。
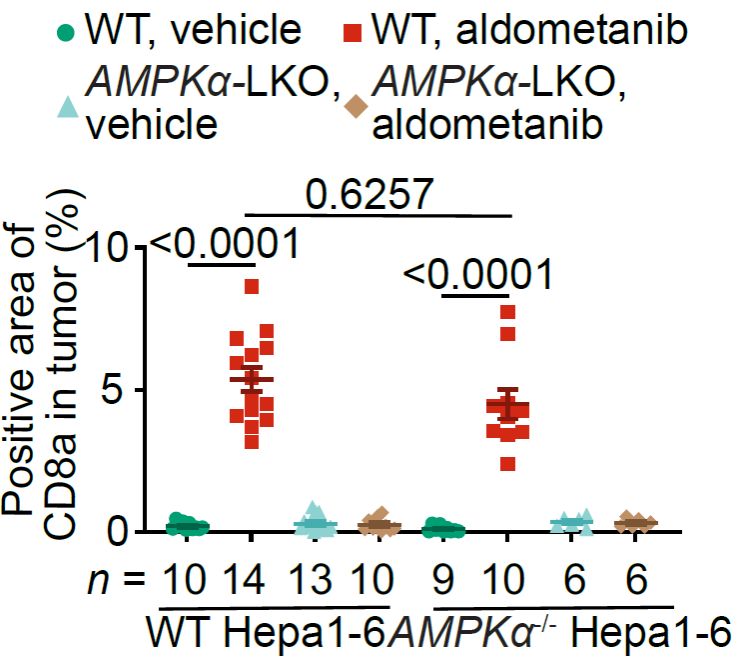
图3:“辟谷精”促进CD8+ T细胞浸润抑制肝癌依赖于癌旁肝细胞内AMPK。
更有意思的是,当作者们对促进CD8+ T细胞浸润肿瘤的趋化因子——CXCL9、10、11进行分析时惊奇地发现,“辟谷精”在促进CD8+ T细胞浸润时,并不上调上述趋化因子的水平。因此,辟谷精如何通过激活肝癌癌旁肝细胞内的AMPK,并募集CD8+ T细胞进入肿瘤,还有待于进一步深入探索。
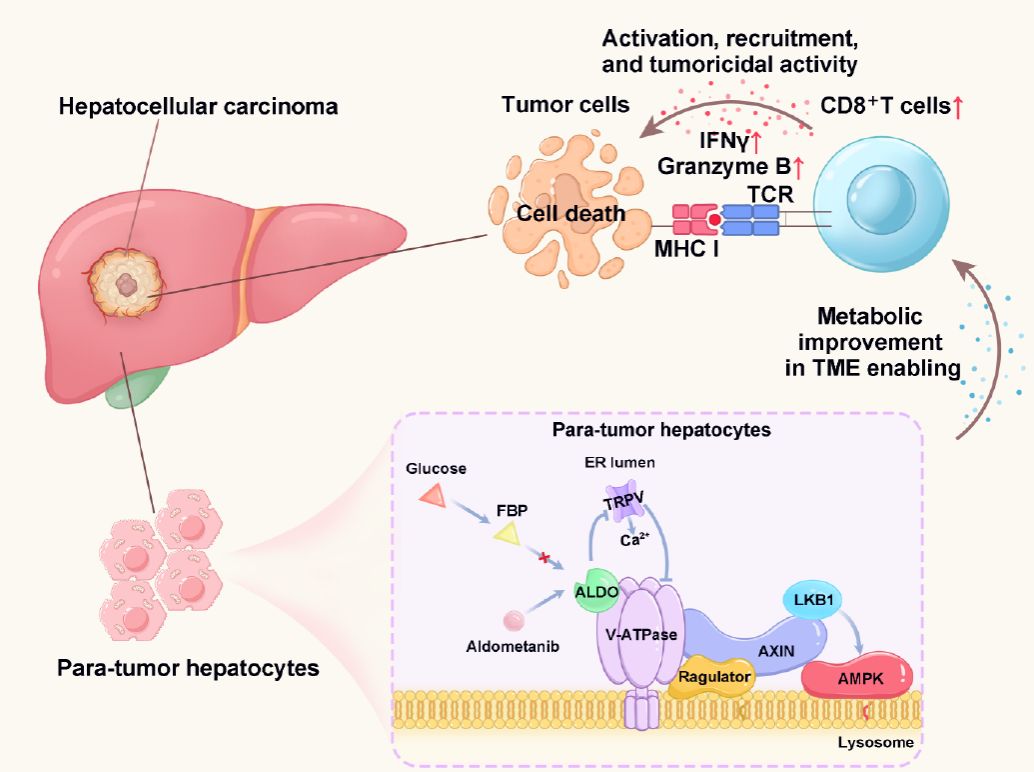
图4: “辟谷精”通过激活肝癌癌旁肝细胞内溶酶体上AMPK改善肿瘤免疫微环境,解除免疫抑制,增强CD8+ T细胞浸润肿瘤组织和杀伤肿瘤细胞的能力,从而抑制肝癌生长,实现小鼠荷瘤生存。
总而言之,“辟谷精”通过激活肝癌癌旁肝细胞内AMPK,改善肝细胞代谢状态,即以代谢干预的方式改善肝癌免疫微环境,为促进抑癌的免疫细胞进入肿瘤组织扫清了障碍,从而延长肝癌小鼠寿命,实现荷瘤生存(图4)。这一发现不仅打破了肿瘤治疗靶点的传统认知,更是开创性地提出了“免疫代谢”的肝癌治疗策略,为肝癌治疗提供了非细胞毒性的新路径,也为将癌症变为“可控慢性病”的愿景铺就了道路。
厦门大学生命科学学院博士生胡辉辉为论文第一作者,福建省肿瘤医院研究员王雪枫,兰斌为论文共同第一作者,厦门大学林圣彩院士,张宸崧教授,福建省肿瘤医院刘景丰教授为通讯作者。该研究得到了国家科技部重点研发计划,国家自然科学基金等资助。
论文链接:https://www.nature.com/articles/s41422-025-01195-4