检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近日,厦门大学崔勇教授团队在国际知名学术期刊Autophagy发表题为SH3P2-mediated autophagosomal targeting of the CCZ1-MON1-RABG3e module regulates autophagosome-vacuole fusion in Arabidopsis的研究论文,首次系统性地揭示了植物自噬体与液泡融合的关键分子机制。

植物自噬通过降解受损细胞器与蛋白质聚集体,帮助植物应对多种生物及非生物胁迫,并保障其正常生长发育。然而,一个长期悬而未决的问题一直困扰着植物自噬领域:植物自噬体到底是如何与液泡融合的?在动物和酵母细胞中,RAB7/Ypt7是众所周知的自噬体与溶酶体/液泡融合调控因子。然而,植物中的情况却十分复杂:有研究观察到RABG3b与ATG8共定位,通过促进自噬来增强免疫相关的细胞死亡反应;但也有研究显示RABG3f不参与自噬,mon1突变体的自噬似乎也未严重缺陷。因此,植物中RAB7家族是否真正参与自噬,一直存在激烈的争论。
研究人员首先通过对RABG3家族蛋白进行系统定位分析,发现RABG3e能够特异性定位于ATG8e标记的环状晚期自噬体上,而不定位在ATG13a标记的早期自噬泡上,提示其主要参与自噬体成熟阶段。进一步的生化和遗传学分析显示,RABG3eT22N、mon1、ccz1a ccz1b突变体中的自噬通量显著下降,且均表现出早衰和对氮素缺乏敏感的表型。透射电镜(TEM)和电子断层扫描揭示了令人惊讶的结果:在RabG3e功能失活突变体中,自噬体不断被新的膜层包裹,形成“洋葱圈式”的异常结构。
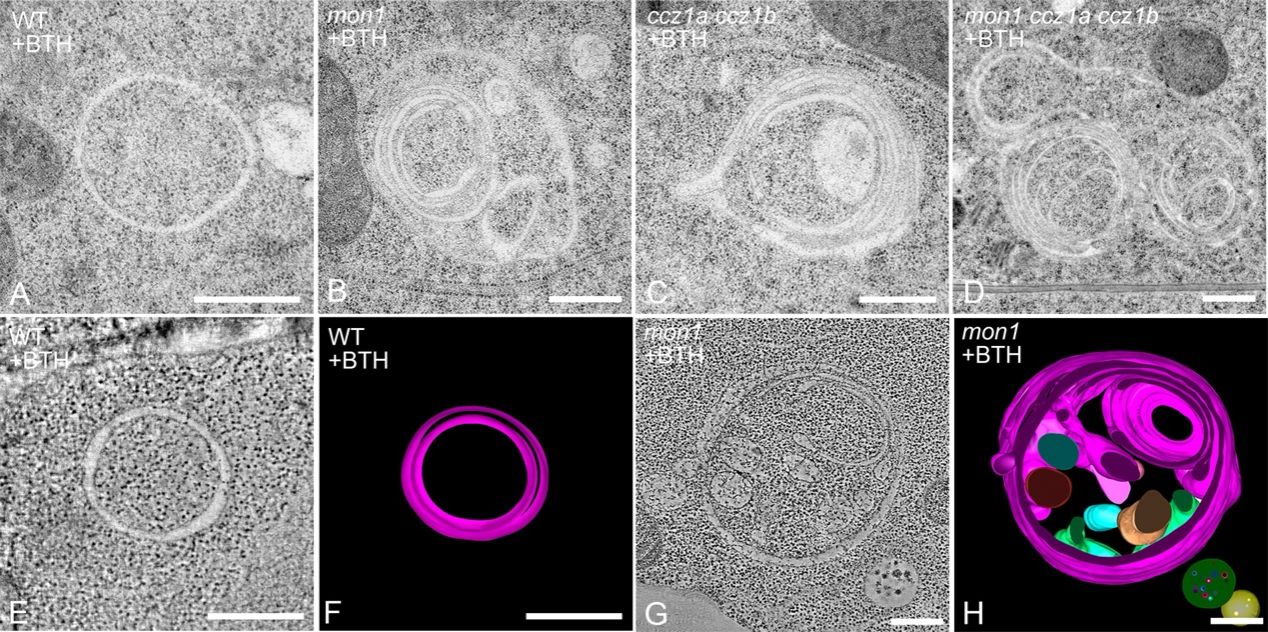
图1. mon1、ccz1a ccz1b和mon1 ccz1a ccz1b突变体中多层自噬体积累
此外,通过蛋白互作和共定位实验,研究人员证明在自噬诱导条件下,SH3P2显著富集于ATG8阳性的成熟自噬体表面,并通过与CCZ1相互作用,将CCZ1-MON1复合体招募到自噬体膜上。原生质体瞬时表达实验显示,在共转amiR-sh3p2质粒的细胞中,RabG3e与ATG8e的共定位消失,说明SH3P2介导CCZ1-MON1的正确靶向是RabG3e定位于自噬体的前提。
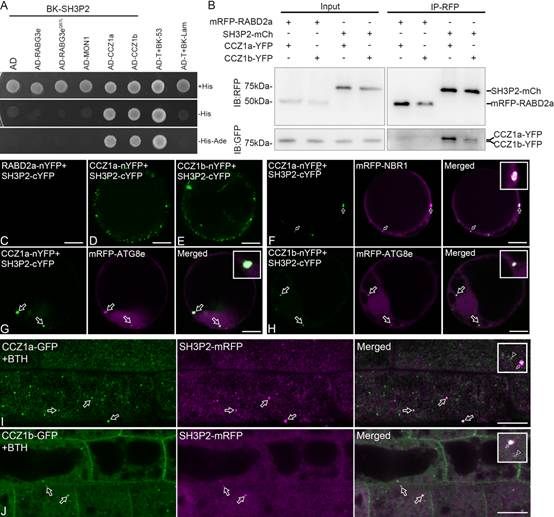
图2. BTH诱导下CCZ1由SH3P2募集至自噬体膜
进一步研究表明,由CCZ1-MON1激活的RABG3e可作为核心膜融合开关,特异性招募HOPS复合体关键亚基VPS39到自噬体与液泡融合界面。VPS39的敲低导致自噬体在细胞质中大量堆积,提示其在自噬体与液泡融合中起关键作用。蛋白质互作质谱和酵母双杂实验进一步揭示,在VPS39与VCL1的协同作用下,SYP21、VTI12、SYP51和VAMP711能够组装成特异的SNARE融合复合体,从而驱动自噬体膜与液泡膜的最终融合。
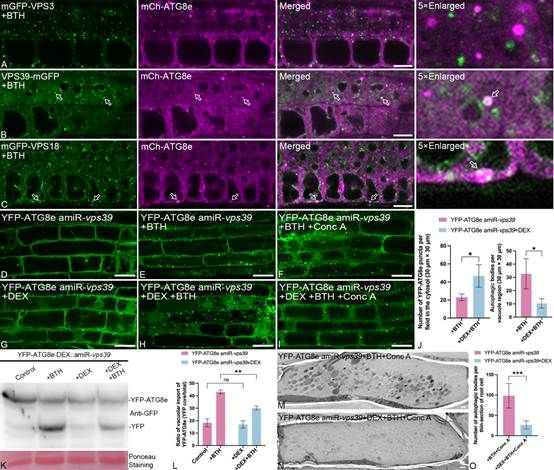
图3. VPS39在自噬体与液泡融合过程中具有重要功能
综上所述,研究人员通过显微成像、遗传学、蛋白互作和超微结构分析,揭示了RAB7家族成员RABG3e在植物自噬体与液泡融合中的核心作用,并首次构建了一个由SH3P2→CCZ1-MON1→RABG3e→VPS39→SNARE复合体依次串联的全新调控模型。这项研究不仅解决了植物自噬研究中的一个重要争议,也为未来解析农作物抗逆提供了理论基础。
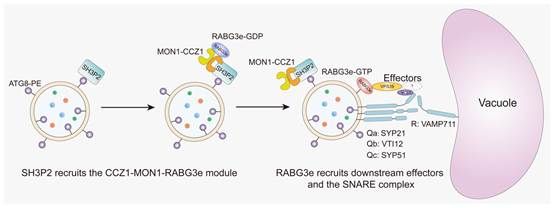
图4. 植物自噬体与液泡融合的工作模型
厦门大学崔勇教授为本论文的唯一通讯作者。厦门大学博士研究生郑晓慧、已毕业硕士研究生詹晓彤、博士研究生唐淑菲、博士后李彦斌、张海副教授为本论文共同第一作者,厦门大学博士研究生齐青、香港中文大学博士后高嘉阳、福建医科大学吴淙贤助理研究员、付志飞教授、香港理工大学Wilson Chun Yu Lau教授、东京大学Takashi Ueda教授和香港中文大学姜里文教授参与了本项工作。该研究得到了国家自然科学基金、福建省自然科学基金和香港研究资助局基金等项目的支持。
论文链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2025.2593138