检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
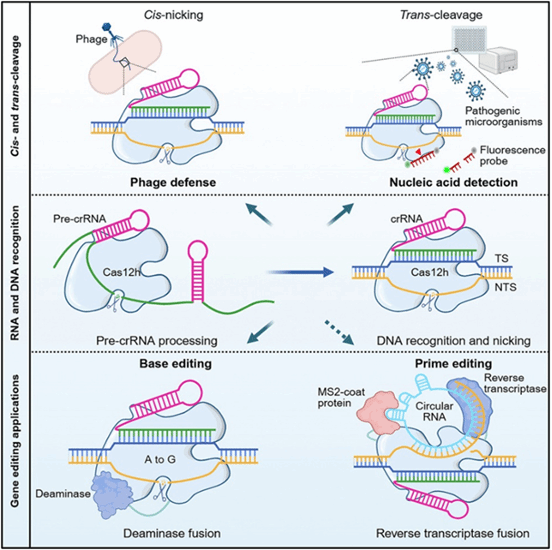
2025年5月14日,刘亮教授团队在Cell Reports在线发表了题为Cas12h is a crRNA-guided DNA nickase that can be utilized for precise gene editing的研究论文。该研究揭示了新型CRISPR-Cas12h系统作为crRNA引导的dsDNA切口酶(Nickase)的分子机制,并成功开发出精准的碱基编辑器。这一发现为精准基因编辑和分子诊断提供了全新工具,有望推动基因治疗等领域的革新。

近年来,随着基因编辑技术迅速发展,CRISPR-Cas系统已成为生命科学与医学领域进行基因操作的核心工具。然而,现有Cas9和Cas12家族蛋白多依赖双链DNA切割,可能引发基因组不可控损伤。为了克服这些局限,研究人员正在不断探索更安全、更精准的基因编辑工具。
Cas12h是V-H型CRISPR-Cas系统的效应蛋白,首次在高盐湖沉积物的宏基因组中发现,但是关于其作用机制知之甚少。刘亮教授团队通过研究发现,Cas12h具有dsDNA切口酶活性。Cas12h依赖RuvC结构域对pre-crRNA的间隔区进行加工,并对dsDNA底物的非靶标链(NTS)进行切割,形成单链缺口。这一切口酶活性使其在基因编辑领域具有广泛的应用前景。
与Cas9和Cas12a相比,Cas12h的蛋白尺寸更小(870个氨基酸),仅需单一crRNA引导,显著降低了基因递送难度。其单链切割特性可避免传统编辑工具的细胞毒性,为碱基编辑(Base Editing)和先导编辑(Prime Editing)等新型技术提供了更安全的引导系统。基于这些优势,刘亮教授团队将Cas12h与腺嘌呤脱氨酶融合,开发了一款腺嘌呤碱基编辑器,实现了体内对A到G碱基的精准替换。团队成员通过优化各种参数,如温度、融合顺序及连接子长度等,进一步提升了碱基编辑器的编辑效率。这些改进不仅提高了编辑的成功率,也为未来更复杂的基因编辑任务奠定了基础。同时,刘亮教授团队指出,Cas12h的切口酶活性使其成为先导编辑系统的理想选择。通过优化Cas12h与逆转录酶等组件的融合策略,未来有望开发基于Cas12h的先导编辑工具,为治疗由多个基因突变引起的复杂遗传疾病提供有力支持。
此外,刘亮教授团队发现Cas12h具有靶DNA激活的反式核酸切割活性。基于这一特性,团队结合核酸扩增技术,开发了一款高灵敏度的核酸检测平台,能够实现对猴痘病毒B6R基因低至2.4拷贝/微升的检测,展示了Cas12h在核酸检测领域的巨大潜力。
厦门大学生命科学学院刘亮教授和陈霁云助理教授为该论文的共同通讯作者, 2020级博士研究生相文文为该论文的第一作者,博士研究生林晓峰、杨云骞、黄玲珑以及陈莹参与了该论文的研究。该研究得到了国家自然科学基金、厦门市自然科学基金和福建省自然科学基金的支持。
原文链接:https://doi.org/10.1016/j.celrep.2025.115718
(图/文 刘亮课题组)