检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
肠道微生物能够产生大量小分子代谢产物,其中包括次级胆汁酸。微生物来源的代谢产物与宿主的生理功能和疾病密切相关,然而这些代谢物和宿主互作的分子机制仍在很大程度上尚未明确。次级胆汁酸具有抗菌作用、也能作为信号分子与宿主的核受体相互作用并调节宿主的免疫和代谢,结构上的细微变化会显著影响其与宿主核受体的结合能力及其对宿主生理功能的调控。然而,从功能角度剖析这些次级胆汁酸对宿主生理功能的影响仍面临两大挑战:首先,许多次级胆汁酸的结构未被鉴定,宿主胆汁酸池的组成极为复杂,其中包含大量分子式相同但键合方式不同的同分异构体,这使得人们难以明确地对这些胆汁酸加以区分;其次,尽管这些胆汁酸可以在人体中被检测到,但它们的产生在个体之间存在较大差异,而且在生物样本中的含量较低,常常限制了它们的进一步分离和功能研究。
2025年4月15日,金文兵教授团队在Cell上在线发表题为Microbiota-derived bile acids antagonize the host androgen receptor and drive anti-tumor immunity的研究论文,该研究结合胆汁酸代谢组学与合成生物学,对207种潜在的微生物胆汁酸羟类固醇脱氢酶(HSDH)进行了功能分析,成功鉴定出56种新型胆汁酸,并发现其中一类胆汁酸是有效的雄激素受体(AR)拮抗剂,能够抑制与AR相关的基因表达,且具有明确的人体相关性,并进一步展示了其中一种胆汁酸以依赖于CD8+ T细胞中AR信号通路的机制抑制肿瘤的发生进展,同时增强免疫检查点抑制剂(anti-PD-1)的治疗效果。

研究团队首先从肠道微生物蛋白库中分析挑选了207个可能的羟类固醇脱氢酶(HSDH),将其构建到质粒上并转入经过基因编辑工程化的大肠杆菌(敲除大肠杆菌本身的7α-HSDH,随后引入胆汁酸转运基因baiG)中进行异源表达,通过对已知胆汁酸底物的已知转化确定了这些HSDH的催化活性(基于HSDH对胆汁酸3, 7, 12位α或β构型羟基的氧化或还原功能,将其归属于3α, 7α, 12α, 3β, 7β, 12β-HSDH中的其中一种),进一步通过这些HSDH对多种结构各异的胆汁酸底物进行转化,最终分离鉴定得到了56种结构新颖的胆汁酸,并通过胆汁酸代谢组学分析发现这些新型胆汁酸广泛存在于哺乳动物体内。
随后,团队筛选了所发掘的新型胆汁酸作为信号分子与宿主的核受体的相互作用,发现一类结构上具有相似性的胆汁酸(3-oxo-Δ5-LCA,3-oxo-Δ4-LCA和3-oxo-Δ4,6-LCA)是活性良好的AR拮抗剂,这些胆汁酸可以与AR的配体结合域紧密结合,并抑制AR相关的基因表达以及细胞生长。
通过代谢组学和宏基因组分析,作者发现这些具有AR拮抗活性的胆汁酸在人体肠道和血液中普遍存在,其生物合成基因在肠道微生物中也广泛存在,且编码对应基因的肠道菌也在体外和宿主体内表现出产生这些活性胆汁酸的能力。
基于此,团队进一步研究了活性胆汁酸能否通过拮抗AR调节宿主肿瘤免疫,发现胆汁酸3-oxo-Δ4,6-LCA可以显著抑制小鼠膀胱癌肿瘤的发生发展,并且增强anti-PD-1的治疗效果;而该抑制效果在去势雄鼠中并不明显,表明该活性胆汁酸的肿瘤抑制效果依赖于小鼠体内的雄激素受体。
在此基础上,作者对肿瘤微环境中的免疫细胞进行了单细胞测序,发现胆汁酸3-oxo-Δ4,6-LCA处理组的肿瘤微环境免疫细胞中具有干细胞特性的CD8+ T细胞比例显著增加,并且流式分析也显示分离到的naïve CD8+ T细胞以及肿瘤微环境中的CD8+ T在3-oxo-Δ4,6-LCA的作用下均相比于对照组表现出更强的干细胞特性。
通过进一步的敲除鼠实验,作者发现胆汁酸3-oxo-Δ4,6-LCA对肿瘤的抑制效果在CD8+ T细胞的Ar基因敲除的小鼠中并不明显,证明其抗肿瘤免疫调控依赖于小鼠体内CD8+ T细胞的AR信号通路。
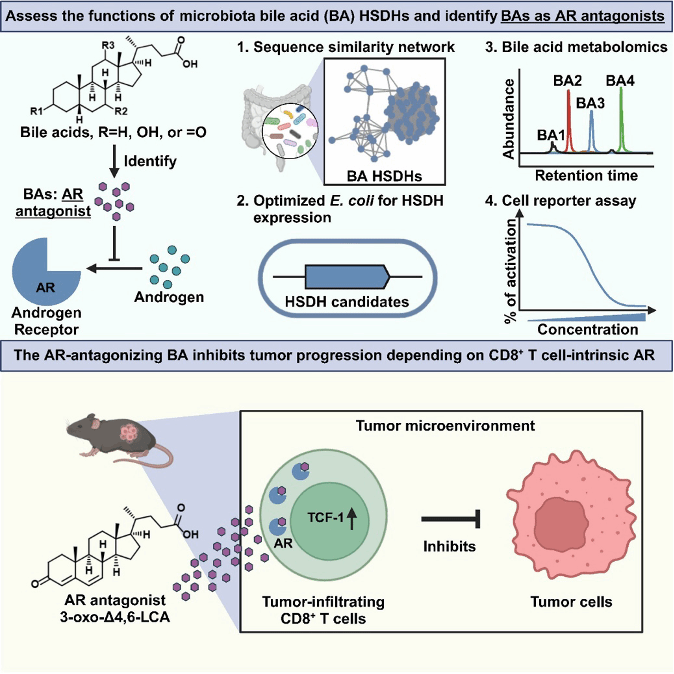
综上所述,研究团队通过结合生物信息学、代谢组学以及合成生物学,挖掘了肠道中广泛存在的一系列新型胆汁酸,通过对这些胆汁酸进行活性筛选发现一类具有良好AR拮抗活性的胆汁酸,并证实该类胆汁酸可通过拮抗CD8+ T细胞中的AR在宿主体内起到抗肿瘤免疫调节的作用。
该研究由厦门大学生命科学学院教授金文兵(共一第一作者,共同通讯作者)和康奈尔大学博士生肖乐怡完成,康奈尔大学Nicholas Collins、David Artis和郭春君教授为共同通讯作者。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(25)00256-9
(文/图 金文兵团队)