检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2025年3月, 袁晶课题组在Nature Communications杂志发表题为 “Elevated NAD+ drives Sir2A-mediated GCβ deacetylation and OES localization for Plasmodium ookinete gliding and mosquito infection” 的研究论文。该研究发现了疟疾传染病病原——疟原虫通过按蚊传播的关键分子, 阐明了疟原虫动合子运动起始的信号调控机制。

疟原虫是单细胞寄生原虫,每年导致数亿人口感染疟疾和超过60万人死亡。疟原虫严格通过雌性按蚊传播。疟疾病人被按蚊叮咬吸血后, 疟原虫雌雄配子在按蚊消化道中受精形成受精卵合子, 进一步变形发育为新月形动合子, 并且启动动合子运动。只有获得运动能力的动合子, 才能主动穿越按蚊消化道上皮, 建立按蚊媒介感染。动合子运动是由环磷酸鸟苷(cGMP)信号控制的。然而, cGMP信号激活机制长期未知。
课题组之前研究(Current Biology, 2018, https://news.xmu.edu.cn/info/1003/11968.htm)发现, 疟原虫合子-动合子发育过程中, GCβ(cGMP合成酶)和PDEδ(cGMP分解酶)时空协同, 精准调控cGMP信号激活。GCβ由细胞质分布动态转移到成熟动合子顶端一侧极性点(ookinete extrados site, OES)集中, 而PDEδ始终保持胞质分布。cGMP信号合成酶和分解酶的时空分离,打破了cGMP信号合成和分解平衡, 提高了OES局部cGMP浓度, 从而起始cGMP信号通路和激活动合子运动。该研究阐明了疟原虫动合子运动cGMP信号激活机制。 然而上述过程中GCβ定位动态变化的调控机制至今未知。
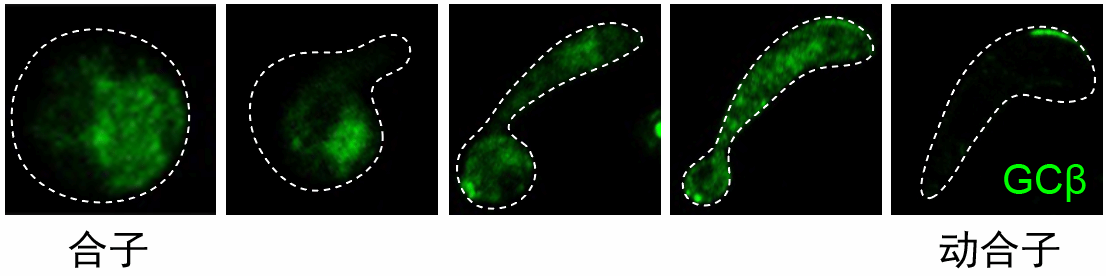
为了回答上述问题,在本研究中通过蛋白临近标记方法和蛋白质谱鉴定出动合子GCβ互作蛋白Sir2A。在合子-动合子变形过程中, Sir2A呈现出和GCβ相同的动态定位, 动合子成熟前胞质定位,动合子成熟时OES定位。Sir2A基因敲除虫株中, 动合子GCβ丢失OES集中定位, 动合子运动能力显著下降, 最终疟原虫按蚊传播完全阻断。
Sir2A发挥NAD+依赖的去乙酰化酶功能。在配子体阶段, Sir2A与GCβ不互作, GCβ保持乙酰化修饰;合子阶段, Sir2A与GCβ互作,但GCβ乙酰化水平没有明显改变;在成熟动合子阶段, Sir2A与GCβ互作, GCβ乙酰化水平显著下降。

Sir2A在合子-动合子变形过程中对底物 GCβ 催化活力的潜在阶段差异, 暗示 Sir2A自身酶活存在调控。通过N AD + 荧光探针检测发现 , 在配子体-合子-动合子发育过程中,配子体和合子阶段胞内N AD + 水平低 , 依赖NAD + 的Sir2A去乙酰化酶不能激活。在合子-动合子发育过程中, 胞内NAD + 水平显著升高, 在成熟动合子阶段达到最高 , 激活Sir2A去乙酰化酶活 , 催化 GCβ 去乙酰化 , 调控 GCβ 由 细胞质分布 转移到成熟 动合子 OES 定位。
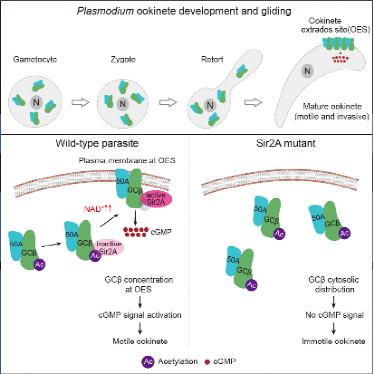
该研究揭示了疟原虫按蚊传播过程中动合子运动信号激活的调控机制, 阐明了细胞代谢物NAD+激活NAD+依赖的去乙酰化酶Sir2A酶活, 催化GCβ去乙酰化,回答了疟原虫细胞发育过程中时空维度精准启动GCβ集中定位并且激活cGMP信号通路的细胞分子机制。
该研究由博士毕业生石阳(第一作者)、已毕业硕士生万琳和硕士生焦梦梦完成。袁晶教授和钟传奇副教授为共同通讯作者,厦门大学为第一完成单位。该研究得到国家自然科学基金委资助。
原文链接:https://www.nature.com/articles/s41467-025-57517-y
(文/图 袁晶课题组)