检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2025年2月25日,生命科学学院刘亮教授团队在《Nucleic Acids Research》期刊上在线发表了题为“Structural basis of ssDNA-guided NADase activation of prokaryotic SPARTA system”的研究论文,该研究首次揭示了细菌在外源单链DNA引导下,SPARTA免疫系统独特激活的分子机制。这一发现不仅深化了人们对原核生物免疫系统有效抵抗病毒机制的理解,同时为开发基于SPARTA系统的核酸操作工具提供了新的研究视角。特别值得注意的是,该研究充分展现了SPARTA系统在分子诊断领域的应用潜力。
Argonaute(Ago)蛋白广泛存在于细菌、古菌和真核生物中,参与调控生物体多个重要的生理过程。原核生物pAgo可分为长pAgo和短pAgo两大类:长pAgo与真核生物eAgo相似,由N-PAZ-MID-PIWI四个结构域组成,通常利用guide RNA或guide DNA结合并降解入侵的质粒与噬菌体DNA,在原核生物免疫防御系统中发挥重要作用;而短pAgo仅由MID和PIWI结构域组成,且缺失切割核酸底物相关的催化活性中心,目前对其生物学功能和机制仍知之甚少。值得注意的是,短pAgo在原核pAgos中占比高达58%,其如何发挥生物学功能及相关分子机制一直是该领域亟待解决的重要问题。
近期研究表明,短pAgo蛋白可与NADase相关的TIR、SIR2结构域偶联,分别形成异源二聚体SPARTA(short prokaryotic Argonaute and the associated TIR-APAZ)和SPARSA(short prokaryotic Argonaute and associated SIR2-APAZ)。这些复合物通过guide RNA或guide DNA结合入侵的target DNA,引发细菌内部NADase的持续性激活,最终导致被侵染的细菌因NAD(P)+耗竭而死亡。然而,这类原核pAgo蛋白相关系统如何识别外源核酸并激活细菌NADase活性的分子机制仍有待阐明。
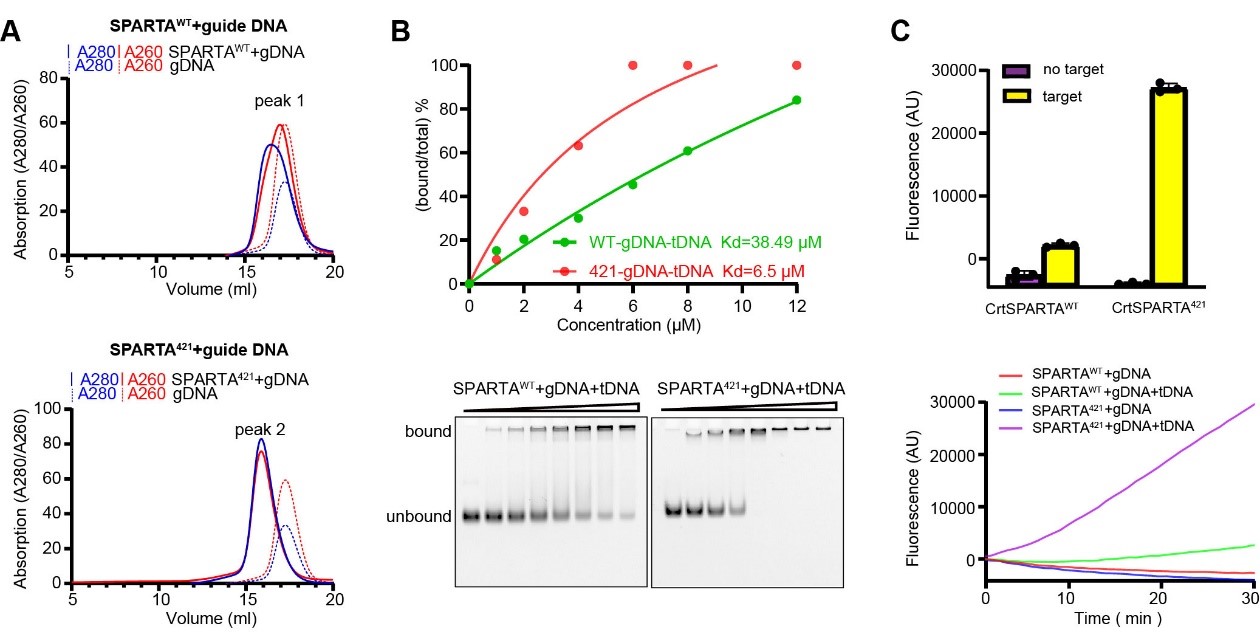
图1:SPARTA截短体能高效识别guide DNA和靶DNA
在研究SPARTA系统的过程中,刘亮团队发现嗜热菌CrtSPARTA野生型蛋白存在自抑制状态,其识别guide DNA的能力较弱。为解除这一抑制状态,研究人员通过多个截短设计成功获得了功能活化的截短体蛋白。实验表明,该截短体蛋白能够在guide ssDNA的引导下与target ssDNA形成稳定的三元复合物,并释放其NADase活性(图1)。进一步的体外酶活实验揭示,target长度对SPARTA-gDNA-tDNA复合物的酶活性具有关键影响,只有当target长度超过16 bp时才能有效激活NADase活性。为深入探究SPARTA系统识别核酸底物和激活NADase的分子机制,研究团队分别对激活状态的SPARTA-gDNA-tDNA21复合物和未激活状态的CrtSPARTA-gDNA-tDNA16复合物进行了结构解析。通过结构比对发现,这两类复合物中的APAPZ和TIR结构域存在显著的构象变化。此外,虽然gDNA和tDNA核酸链均结合于APAZ和MID结构域形成的凹槽中,但在两种结构中呈现出完全相反的结合方向:在16 nt tDNA结构中,5′末端的第1个核苷酸C15破坏了gDNA-tDNA双链,并与Tyr148和His207发生侧链堆积作用;而在21 nt tDNA结构中,这种堆积作用则是由3′末端的第2个核苷酸A1形成的。研究结果表明,SPARTA系统对这两种不同长度的target的分子识别机制差异,可能是导致两类复合物NADase激活效率不同的关键原因。
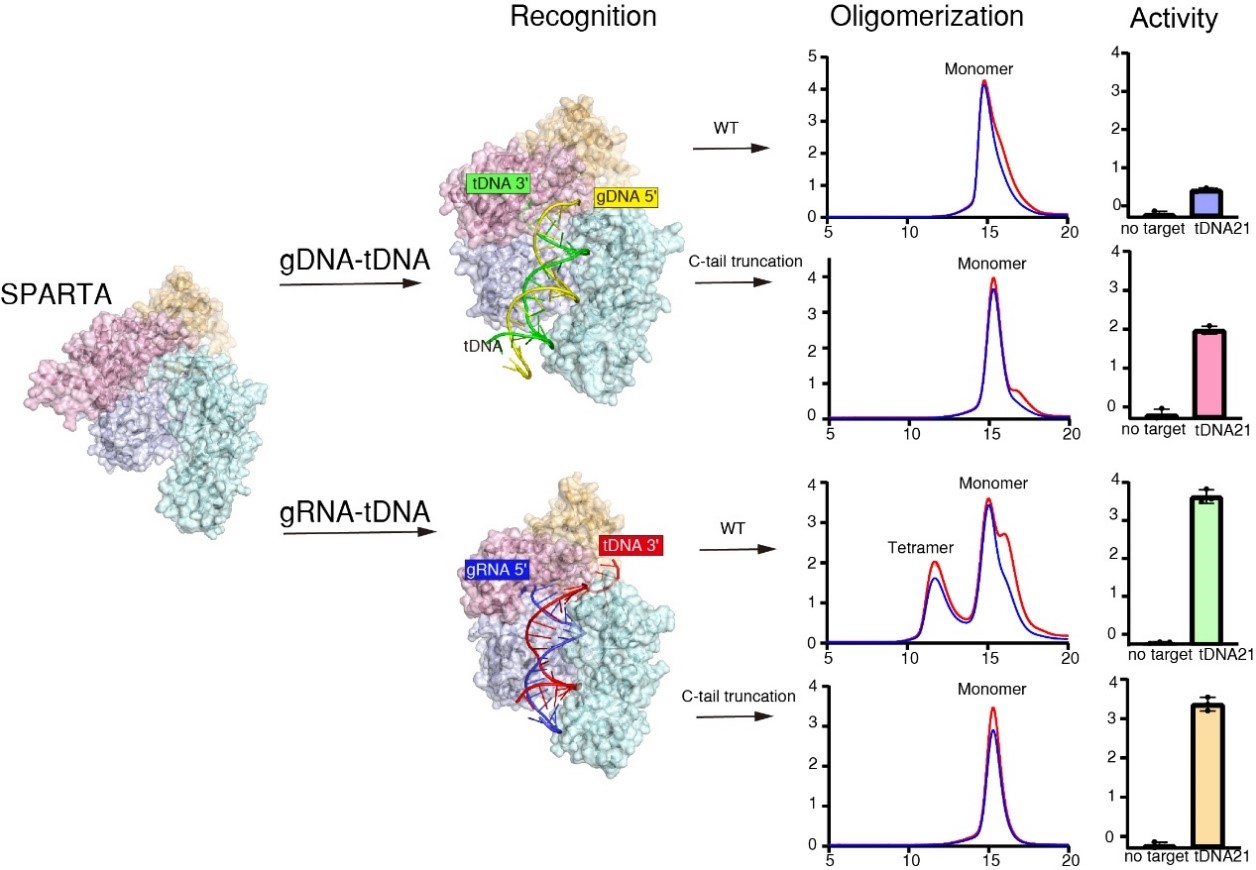
图2:不同的gRNA、gDNA识别方式和SPARTA激活机制
SPARTA系统可被guide DNA和guide RNA引导激活。为全面阐明SPARTA系统参与原核生物免疫的途径与机制,研究人员通过分子凝胶阻滞实验、体外酶活实验与结构叠加分析,系统比较了CrtSPARTA-gRNA-tDNA和CrtSPARTA-gDNA-tDNA两种复合物的NADase激活机制差异(图2)。实验结果表明,CrtSPARTAWT-gRNA-tDNA在激活过程中会形成四聚体复合物,而CrtSPARTAWT-gDNA-tDNA则保持单体状态,呈现出NADase未激活状态。值得注意的是,在解除自抑制区域后,截短体复合物CrtSPARTA421-gDNA-tDNA虽呈现出NADase活性,但并未形成四聚体。这一发现表明,SPARTA系统可被不同类型的引导核酸激活,且四聚体的形成可能并非NADase激活的必要条件。为进一步阐明两类复合物激活机制的差异,研究人员通过结构叠加分析比较了SPARTA蛋白对gDNA-tDNA与gRNA-tDNA核酸底物的结合特征。研究发现,尽管SPARTA-gDNA-tDNA与SPARTA-gRNA-tDNA具有相似的整体结构,但其对gRNA和gDNA的识别模式存在显著差异:在gRNA-tDNA复合物中,第一个gRNA的5′ P基团会翻转并锚定在MID口袋中,且Mg2+参与识别过程;而在gDNA-tDNA复合物中,同样的结合口袋和Mg2+识别网络则容纳tDNA的3′ OH基团。值得注意的是,SPARTA-gDNA-tDNA独特的结合方式与所有已知pAgo蛋白及其相关复合物的核酸结合模式均不相同,且两类复合物的引导链与靶标链在结构上呈现相反的取向。
本研究不仅揭示了SPARTA-gDNA-tDNA独特的核酸识别机制和原核免疫系统激活机制,基于SPARTA-gDNA-tDNA系统中Ago蛋白识别底物的特异性以及NAD+降解产物检测的简便性,该研究成果还为SPARTA系统在分子诊断与核酸检测领域的应用提供了重要理论支持。虽然已有研究团队针对SPARTA-gRNA-tDNA系统的核酸检测应用进行了初步探索并取得良好效果,但本研究中基于gDNA-tDNA的诊断分子具有更强的稳定性和更低的经济成本,因此SPARTA-gDNA-tDNA系统在分子诊断领域展现出巨大的应用潜力。
厦门大学生命科学学院刘亮教授和陈霁云助理教授为该论文的共同通讯作者,博士后胡荣为该论文的第一作者,2023级博士生郭晨旻和2021级博士生刘笑天参与了该论文的研究,2019级本科生林元一、2020级本科生杨子昕、李芷昕和2022级本科生杨晔、马尔蔓、李依衣也参与了该论文的相关工作。该研究得到了国家自然科学基金、福建省自然科学基金和的厦门市自然科学基金支持。
原文链接:https://academic.oup.com/nar/article/53/4/gkaf110/8042003?searchresult=1
(文/图 刘亮教授课题组)